近日,湖北大学生命科学学院与省部共建生物催化与酶工程国家重点实验室李壮课题组在《Molecular Cell》上发表题为《Mechanisms for HNH-mediated target DNA cleavage in type I CRISPR-Cas systems》(I型变体CRISPR-Cas系统通过HNH核酸酶实现靶DNA精准切割的工作机理)的研究论文。该研究发现,crRNA介导的靶DNA定位和靶DNA诱导的HNH构象变化是其精准切割靶DNA的关键因素。研究生张晨滴、陈福根、王凤、徐海江和薛佳琳为该论文的共同第一作者,李壮副教授为该论文的通讯作者。

图1文章封面
CRISPR-Cas系统广泛存在于细菌和古细菌中,用于抵抗外来核酸的入侵。CRISPR-Cas系统目前可以划分成两大类7种类型,其中I型是原核生物中存在丰度最高的类型,包含多种亚型(I-A到I-G)。I型系统通过形成Cascade复合物,并招募Cas3核酸酶来实现对靶DNA的降解。最新的生物信息学研究发现了两个I型变体系统(此处命名为I-EHNH和I-FHNH),它们都缺乏Cas3核酸酶但却在核心亚基上融合了HNH核酸酶结构域,以实现对靶DNA的切割。这两种系统都可以通过重编程在哺乳动物细胞中产生突变,显示出了巨大的基因组编辑潜力。然而,它们的工作机理一直不清楚。
本研究首先解析了多种状态下的I-EHNH和I-FHNH变体复合物的冷冻电镜结构,发现与常规复合物的整体结构具有较高的相似性。对I-FHNH变体复合物工作机理的进一步研究发现,完整R-loop结构的形成会触发该复合物的构象变化,并造成HNH核酸酶发生巨大的翻转,以实现对靶DNA的精准切割。对I-EHNH变体复合物工作机理的进一步研究发现,crRNA与靶DNA的完整配对会触发该复合物的构象变化,并使得HNH核酸酶和Cas11e形成的底物切割孔道变宽,因此靶DNA得以进入切割位点并被切割。总的来说,本研究通过系统的结构和生化研究,阐明融合了HNH核酸酶结构域的I型CRISPR-Cas变体系统的工作机理,为进一步的基因编辑应用和优化开发做了铺垫。
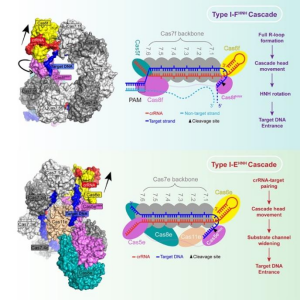
图2I-FHNH和I-EHNHCascade变体复合物的工作机理示意图
据悉,李壮课题组一直致力于可编程核酸酶的基因挖掘、生化性质、以及工作机理的探究。自2022年成立实验室以来,以通讯作者在Molecular Cell(2篇)、Nucleic Acids Research(2篇)、Cell Research、Nature Communications等学术期刊多篇研究论文。该研究得到了科技部重点研发计划、国家自然科学基金支持。
文章链接:https://doi.org/10.1016/j.molcel.2024.06.033