Argonaute蛋白是一类存在于各种生物界中的古老蛋白,参与多种重要的生理过程。原核Argonaute (pAgo) 主要分为长pAgo和短pAgo蛋白。长pAgo使用RNA或者DNA作为向导 (guide) 序列抵御外来遗传物质的入侵,最近的研究也表明他们参与了DNA复制、DNA加工及修复。长pAgo和真核Argonaute一样,都具有四个保守的结构域,主要由N、PAZ、MID和PIWI结构域组成。围绕多个物种的长pAgo,已经有比较细致的机理研究,比如: 切割活性激活过程中glutamate finger插入活性中心及三个催化关键Loop的构象变化、guide和靶末端碱基/修饰的偏好性结构基础、guide中的seed区域、PAZ结构域对guide 3’末端的识别、N结构域的分类等等。
嗜热古生菌Pyrococcus furiosus来源的Argonaute (PfAgo) 可以通过干扰质粒DNA的转化进行宿主防御。体外生化研究表明,PfAgo可以在高温下使用短的5’磷酸化的guide DNA靶向切割单链和双链DNA。PfAgo作为一种可编程核酸酶,由于其高活性和高特异性,被成功应用于核酸检测和分子克隆。虽然PfAgo是第一个被测定结构 (2004年) 的Argonaute蛋白,但其识别guide和靶并发生特异切割的工作机理尚不清楚。
2024年1月30日,湖北大学李壮和马立新研究团队在Molecular Cell杂志上发表了题为Molecular mechanism for target recognition, dimerization, and activation of Pyrococcus furiosus Argonaute的研究论文。该研究意外地发现,靶DNA会诱导PfAgo产生二聚化,而二聚化通过稳定催化Loop来促进其切割活性。

该研究的具体发现如下:
1. PfAgo三元复合物的结构。作者解析了分辨率为2.9Å的PfAgo-guide DNA-target DNA复合物(以下简称三元复合物)的冷冻电镜结构。三元复合物主要以二聚体形式存在,二聚化依赖于五个界面上发生的相互作用,包括两个PIWI-MID界面、一个PIWI-PIWI界面和两个PAZ-N界面。生化实验表明,打破二聚化的氨基酸突变同样会破坏PfAgo的靶DNA切割活性。该三元复合物结构表明PfAgo采用wedge-type N结构域并容纳一段短的双链guide-target DNA,并阐明了PfAgo偏好5’-磷酸化guide DNA的结构基础。
2. PfAgo的二聚化由靶DNA诱导产生。生化和结构分析显示,在没有靶DNA存在时,PfAgo-guide DNA(以下简称二元复合物)完全以单体形式存在,表明PfAgo的二聚化由靶DNA诱导产生。通过对含有不同长度靶DNA的中间态研究发现,只有guide与靶DNA之间全长匹配才能充分地诱导PfAgo二聚化。二聚化的过程中,PfAgo会发生一系列构象变化,包括PAZ和N结构域的移动以及glutamate finger插入活性中心。冷冻电镜和FRET实验表明,靶DNA被切割之后二聚体会变成单体,表明PfAgo在一个切割循环中发生了“单体-二体-单体”的转变。
3. 二聚化在其他两种嗜热长pAgo中保守存在。作者解析了Thermococcus thioreducens来源Argonaute (TtdAgo) 三元复合物的高分辨率结构。该结构表明TtdAgo也是二聚化的,而且二聚化依赖于相同的五个界面,同时二聚化界面还存在一个额外的锌指结构。未发表的数据表明,来源于Thermogladius calderae的TcAgo也具有类似的二聚化现象。鉴于PfAgo、TtdAgo和TcAgo均为嗜热Ago蛋白,有理由猜测靶DNA诱导的二聚化可能是嗜热pAgo蛋白的一个共同特征。
4. 二聚化通过稳定催化Loop来促进切割活性。最重要的是,在PfAgo和TtdAgo的PIWI-PIWI界面上,都发现了来自两个分子的催化Loop互相稳定的现象,破坏该相互作用会完全破坏切割活性,说明二聚化的功能性意义在于通过催化Loop来促进催化活性。
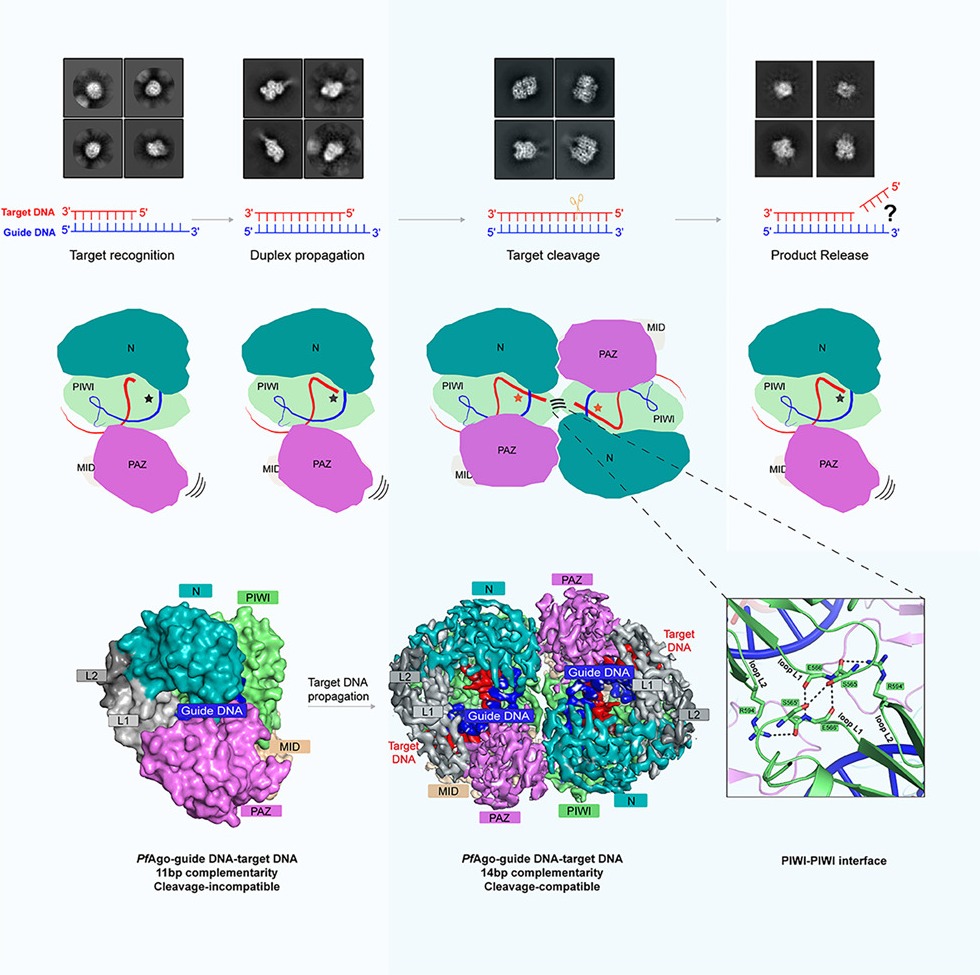
图. PfAgo的工作机理模型
总之,本研究推进了我们对PfAgo的结构和工作机理的理解,对长原核Ago蛋白的工作模式提供了新的维度的见解。但需要指出的是,PfAgo二元复合物的结构以及其它中间态的结构仍有待解析,并可以使我们对PfAgo的工作机理有更加清晰的认识。
湖北大学省部共建生物催化与酶工程国家重点实验室的李壮副教授和马立新教授为该论文的通讯作者,博士后王珑瑜、陈晚苹博士和硕士生张晨滴为该论文的第一作者,博士生谢晓晨、硕士生黄福勇和陈苗苗、副教授毛伍祥、硕士生余娜和魏强参与了研究工作。
原文链接:https://doi.org/10.1016/j.molcel.2024.01.004